Zespół:
Dr Krzysztof Dariusz Pluta - kierownik PIT
Dr Joanna Agata Motyl
Dr inż. Agnieszka Wencel
Dr inż. Małgorzata Jakubowska
Mgr Monika Joanna Wiśniewska (doktorant)
TEMATYKA BADAŃ NAUKOWYCH
Wątroba jest organem o wielkim potencjale regeneracyjnym, jednakże, w przypadku całkowitej utraty jej funkcji, jedyną skuteczną terapię stanowi przeszczep organu. Problem stanowi niedostateczna liczba dawców, skutkiem czego rocznie umiera około 10% pacjentów oczekujących na transplantację wątroby. Z tego powodu, naukowcy na całym świecie szukają alternatywnych dla przeszczepu rozwiązań. Wśród nich znajdują się m.in. hybrydowe systemy wspomagania wątroby. Są to urządzenia zewnętrzne oparte na bioreaktorach zasiedlonych przez komórki wątrobowe, tzw. biosztuczne wątroby (ang. bioartificial livers, BALs), mające za zadanie utrzymać pacjenta przy życiu do czasu regeneracji organu lub jego przeszczepu.
Głównym celem badań realizowanych w naszej Pracowni jest opracowanie biologicznej części BAL. Najlepszym źródłem komórek do zastosowania w takich systemach są ludzkie komórki parenchymalne wątroby – hepatocyty. Jednak bardzo szybko po izolacji odróżnicowują się i tracą one zdolność do pełnienia funkcji wątrobowych. W związku z powyższym w konstrukcji BAL korzysta się z innych źródeł komórek wątrobowych, np. komórek pochodzenia zwierzęcego, nowotworowych linii komórkowych, różnych rodzajów komórek macierzystych czy komórek wyprowadzonych z indukowanych pluripotentnych komórek macierzystych (iPSC). Przykładowo, w najlepiej przebadanym klinicznie systemie wspomagania wątroby – ELAD (ang. extracorporeal liver assist device), zastosowano linię ludzkiego wątrobiaka – C3A. Główną wadą tych komórek jest niefunkcjonalny cykl mocznikowy, a detoksykacja amoniaku jest niezwykle istotnym procesem zachodzącym w wątrobie. To mogło być jedną z przyczyn niepowodzeń tego BALa w leczeniu skrajnej niewydolności wątroby. W odpowiedzi na te wyzwania, w naszej Pracowni wyprowadzono nową modyfikowaną genetycznie (z wykorzystaniem wektorów lentiwirusowych opartych na genomie HIV-1) linię C3A z przywróconym cyklem mocznikowym. Tak zmodyfikowane komórki mogą stanowić lepsze źródło do zastosowania w biosztucznej wątrobie.
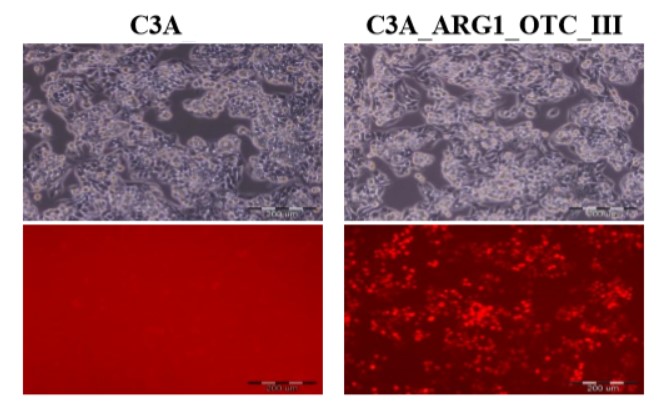 |
Linia komórkowa ludzkiego wątrobiaka (C3A) i jej modyfikowany genetycznie odpowiednik z przywróconym cyklem mocznikowym (C3A_ARG1_OTC_III). Fotografie zostały wykonane z wykorzystaniem mikroskopu fluorescencyjnego Olympus IX71. Panel górny przedstawia obrazy w świetle przechodzącym z kontrastem fazowym, zaś panel dolny ukazuje czerwoną fluorescencję białka mCherry w świetle UV w filtrze UMN-G. Skala 200 µm.
Ponadto w naszej Pracowni powstała nowa mechaniczno-enzymatyczna metoda izolacji ludzkich hepatocytów z fragmentów resekowanych wątrób (materiał pozyskiwany we współpracy z Katedrą i Kliniką Chirurgii Ogólnej, Transplantacyjnej i Wątroby, WUM). Zastosowanie tej techniki pozwala na szybszą izolację komórek przy zachowaniu wyższej żywotności w porównaniu ze standardowo stosowaną metodą podwójnej perfuzji.
 |
Etapy mechaniczno-enzymatycznej izolacji komórek wątrobowych.
W Pracowni Inżynierii Tkankowej prowadzone są również prace nad długoterminowymi hodowlami aktywnych ludzkich hepatocytów. Nasze działania skupiają się m.in. na uzyskaniu nowych podłoży hodowlanych, pozwalających na utrzymanie hepatocytów w stanie zróżnicowanym (np. opracowane przez nas podłoże z suszonych fibroblastów). Hodowanie ludzkich hepatocytów w obecności innych komórek również pomaga podtrzymać ich specyficzne funkcje wątrobowe. W związku z tym w naszej Pracowni poddano modyfikacji genetycznej fibroblasty izolowane z ludzkiej skóry w celu nadprodukcji czynników wzrostu takich jak hepatocytarny czynnik wzrostu (ang. hepatocyte growth factor, HGF) czy epidermalny czynnik wzrostu (ang. epidermal growth factor, EGF), których obecność stwarza wyjątkowo korzystne warunki dla hodowli parenchymalnych komórek wątrobowych.

Fibroblasty wyizolowane z ludzkiej skóry (ang. human skin fibroblast; HSF) i ich modyfikowane genetycznie odpowiedniki nadprodukujące hepatocytarny czynnik wzrostu (HSF_HGF). Fotografie zostały wykonane z wykorzystaniem mikroskopu fluorescencyjnego Olympus IX71. Panel górny przedstawia obrazy w świetle przechodzącym z kontrastem fazowym, zaś panel dolny ukazuje zieloną fluorescencję białka EGFP w świetle UV w filtrze UMN-M. Skala 200 µm.
Hepatocyty nie są jedynymi komórkami zasiedlającymi wątrobę. Inne typy komórek (m.in. komórki śródbłonka naczyń, komórki dróg żółciowych, osiadłe makrofagi, komórki gwiaździste czy różne progenitory) również mają swój ważny udział w budowie i funkcjonowaniu tego narządu. Analiza składu wątroby z wykorzystaniem cytometrii przepływowej jest oryginalną, stale rozwijaną przez nasz Zespół techniką, która pozwoli w przyszłości na opracowanie unikalnej metody prognostycznej i diagnostycznej chorób wątroby.
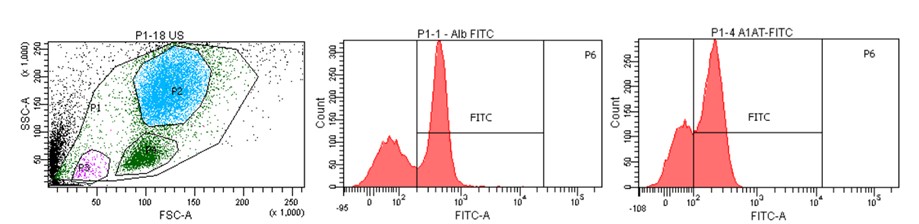
Cytometryczny obraz populacji komórek izolowanych z ludzkiej wątroby wraz z histogramami obrazującymi charakterystyczne markery wątrobowe (albumina, α-1-antytrypsyna).
Wyposażenie:
Pracownia korzysta z Laboratorium Biologicznego zgodnego ze standardem Bezpieczeństwa Biologicznego poziomu 2 (BSL2) i GMO2. Na wyposażeniu znajdują się komory laminarne klasy II, inkubatory CO2, fluorescencyjny mikroskop odwrócony Olympus IX71, cytometr BD FACSCanto II, autoklawy, wirówki z chłodzeniem, termocykler BIORAD oraz drobny sprzęt do biologii molekularnej.
Słowa kluczowe:
inżynieria tkankowa, biosztuczna wątroba, kokultury komórkowe, wektory lentiwirusowe, komórki modyfikowane genetycznie, cytometria przepływowa
Granty naukowe:
1. Projekt Sonatina 3 NCN 2019/32/C/NZ4/00455 "The importance of crosstalk between alpha-synuclein and sphingosine-1-phosphate-dependent signalling in experimental models of Parkinson's disease. Searching for novel therapeutic targets in synucleinopathies."
Kierownik projektu: dr Joanna Agata Motyl
2. Projekt Miniatura 5 NCN 2021/05/X/NZ3/01478 "Ocena funkcjonalna i genetyczna zmodyfikowanych komórek C3A z przywróconym cyklem mocznikowym (C3A_AO) do konstrukcji biosztucznej wątroby i testów hepatotoksyczności leków."
Kierownik projektu: dr inż. Agnieszka Wencel
Wybrane publikacje:
- Motyl JA, Gromadzka G, Czapski GA, Adamczyk A: SARS-CoV-2 Infection and Alpha-Synucleinopathies: Potential links and underlying mechanisms. International Journal of Molecular Sciences, 2024, 25(22):12079. doi: 10.3390/ijms252212079.
- Jakubowska M, Wiśniewska M, Wencel A, Wojciechowski C, Gora M, Dudek K, Chwojnowski A, Burzynska B, Pijanowska DG, Pluta KD: Hollow fiber bioreactor with genetically modified hepatic cells as a model of biologically active function block of the bioartificial liver. Biocybernetics and Biomedical Engineering, 2024, 44(1): 9-19. doi: 10.1016/j.bbe.2023.11.003.
- Motyl JA, Strosznajder JB, Wencel A, Strosznajder RP: Recent insights into the interplay of Alpha-Synuclein and Sphingolipid signaling in Parkinson's disease. International Journal of Molecular Sciences, 2021, 22(12): 6277. doi: 10.3390/ijms22126277.
- Pluta KD, Ciężkowska M, Wiśniewska M, Wencel A, Pijanowska DG: Cell-based clinical and experimental methods for assisting the function of impaired livers - present and future of liver support systems. Biocybernetics and Biomedical Engineering, 2021, 41(1): 1322-1346. doi: 10.1016/j.bbe.2021.06.005.
- Wencel A, Ciężkowska M, Wiśniewska M, Zakrzewska KE, Pijanowska DG, Pluta KD: Effects of genetically modified human skin fibroblasts, stably overexpressing hepatocyte growth factor, on hepatic functions of co-cultured C3A cells. Biotechnology and Bioengineering, 2021, 118(1): 72-81. doi: 10.1002/bit.27551.
- Pluta KD, Samluk A, Wencel A, Zakrzewska KE, Góra M, Burzyńska B, Ciężkowska M, Motyl J, Pijanowska DG: Genetically modified C3A cells with restored urea cycle for improved bioartificial liver. Biocybernetic and Biomedical Engineering, 2020, 40(1): 378-387. doi: 10.1016/j.bbe.2019.12.006.
- Ciężkowska M, Pluta KD: Kliniczne metody wspomagania niewydolnej wątroby. Postępy Biochemii, 2019, 65(3): 193-201. doi: 10.18388/pb.2019_269.
- Zakrzewska KE, Samluk A, Wencel A, Dudek K, Pijanowska DG, Pluta KD: Liver tissue fragments obtained from males are the most promising source of human hepatocytes for cell-based therapies – Flow cytometric analysis of albumin expression. PLoS ONE, 2017, 12(8): e0182846. doi: 10.1037/journal.pone.0182846.
- Wencel A, Zakrzewska KE, Samluk A, Noszczyk BH, Pijanowska DG, Pluta KD: Dried human skin fibroblasts as a new substratum for functional culture of hepatic cells. Acta Biochimica Polonica, 2017, 64(2): 357-363. doi: 10.18388/abp.2016_1481.
- Zakrzewska KE, Samluk A, Wierzbicki M, Jaworski S, Kutwin M, Sawosz E, Chwalibog A, Pijanowska DG, Pluta KD: Analysis of the cytotoxicity of carbon-based nanoparticles, diamond and graphite, in human glioblastoma and hepatoma cell lines. PloS ONE, 2015, 10(3): e0122579. doi: 10.1371/journal.pone.0122579.
- Zakrzewska KE, Samluk A, Pluta KD, Pijanowska DG: Evaluation of the effects antibiotics on cytotoxicity of EGFP and DsRed2 fluorescent proteins used for stable cell labeling. Acta Biochimica Polonica, 2014, 61(4): 809-813. doi: 10.18388/abp.2014_1850.
- Samluk A, Zakrzewska KE, Pluta KD: Generation of fluorescently labeled cell lines, C3A hepatoma cells and human adult skin fibroblasts, to study coculture models. Artificial Organs, 2013, 37(7): E123-30. doi: 10.1111/aor.12064.
- Pluta K, Kacprzak MM: Use of HIV as a gene transfer vector. Acta Biochimica Polonica, 2009, 56(4): 531-595. doi: 10.18388/abp.2009_249.




















